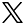アルツハイマー病発症に至る神経老化の機構を明らかにし、これを制御する。


西道 隆臣, Ph.D.
神経老化制御研究チーム チームリーダー
takaomi.saido [at] riken.jp
研究内容
生体内において、個々のタンパク質は固有の寿命を有します。短いものは数分以内にターンオーバーする一方で、長いものは数百時間も存在し続けます。この選択的なタンパク質寿命決定機構を解明することは現代生命科学の長年の課題であり、多くの研究者が取り組んできています。しかしながら、これまでにわかってきたことは、血漿といった限られた部位でのタンパク質代謝や一般的な意味での細胞内タンパク質分解に関する部分的な知見に限られるのが現状です。ましてや、脳内において、どのような機構でタンパク質の寿命が決定されるかは、全く不明といえます。当研究チームは、この新しい課題を開拓すべく、新しい動物実験モデル系を作成する一方で、生化学・分子生物学・細胞/発生工学の手法を駆使した解析を行う計画です。脳内におけるタンパク質代謝が、他の臓器にまして重要であることは、様々な神経疾患の研究から明らかになりつつあります。たとえば、アルツハイマー病・プリオン病・ポリグルタミン病の発症には、それぞれ、βアミロイドペプチド・プリオンタンパク質・ポリグルタミンペプチドの蓄積が深く関っています。これは、多くの神経細胞が分裂後細胞であるために、その機能と生存を維持するために、タンパク質代謝によるタンパク質品質管理機構に強く依存していることを示しています。さらに、脳のタンパク代謝系を知ることによってこれらの病気(あるいはより広く脳の老化)を克服することが出来る可能性のあることを意味しています。本研究では、脳内におけるタンパク質の寿命を決定する機構の解明を通じて、神経変性疾患および脳老化の診断・予防・治療のための基礎的知見を得ることを目的とします。特に、孤発性アルツハイマー病を脳老化の一般的終末像として位置づけ、βアミロイド代謝系の解明を中心的課題とします。一方、細胞内タンパク質分解にも注目し、カルパイン・カスパーゼ・オートファジーの役割についても解析します。さらに、Aβが蓄積してタウが沈着し神経変性が生じるメカニズム(パスウェイ)を同定する試みを進めています。この目的のために、“アミロイド前駆体タンパク質を過剰発現せずにAβ42を過剰産生する”次世代型のアルツハイマー病モデルマウスを作製しました。このモデルは、新たなバイオマーカーの探索にも有用であると期待されます。
研究主分野
総合生物
研究関連分野
生物学 / 医歯薬学
キーワード
- アルツハイマー病
- アミロイド
- タウ
- 神経炎症
- 神経変性
主要論文
- Iwata N, Tsubuki S, Sekiguchi M, Watanabe-Iwata K, Matsuba Y, Kamano N, Fujioka R, Takamura R, Watamura N, Kakiya N, Mihira N, Morito T, Shirotani K, Mann DM, Robinson AC, Hashimoto S, Sasaguri H, Saito T, Higuchi M, Saido TC.
"Metabolic resistance of Aβ3pE-42, a target epitope of the anti-Alzheimer therapeutic antibody, donanemab"
Life Sci Alliance. 2024 Sep 30;7(12):e202402650.
doi: 10.26508/lsa.202402650 - Sato K, Sasaguri H, Kumita W, Sakuma T, Morioka T, Nagata K, Inoue T, Kurotaki Y, Mihira N, Tagami M, Manabe RI, Ozaki K, Okazaki Y, Yamamoto T, Suematsu M, Saido TC, Sasaki E.
"Production of a heterozygous exon skipping model of common marmosets using gene-editing technology"
Lab Anim (NY). 2024 Sep;53(9):244-251.
doi: 10.1038/s41684-024-01424-0 - Watamura N, Kakiya N, Fujioka R, Kamano N, Takahashi M, Nilsson P, Saito T, Iwata N, Fujisawa S, Saido TC.
"The dopaminergic system promotes neprilysin-mediated degradation of amyloid-β in the brain"
Sci Signal. 2024 Aug 6;17(848):eadk1822.
doi: 10.1126/scisignal.adk1822 - Sato K, Watamura N, Fujioka R, Mihira N, Sekiguchi M, Nagata K, Ohshima T, Saito T, Saido TC, Sasaguri H.
"A third-generation mouse model of Alzheimer's disease shows early and increased cored plaque pathology composed of wild-type human amyloid β peptide"
J Biol Chem. 2021 Sep;297(3):101004.
doi: 10.1016/j.jbc.2021.101004 - Hashimoto S, Matsuba Y, Kamano N, Mihira N, Sahara N, Takano J, Muramatsu SI, Saido TC, Saito T.
"Tau binding protein CAPON induces tau aggregation and neurodegeneration"
Nat Commun. 2019 Jul 1;10(1):2964.
doi: 10.1038/s41467-019-10990-8 - Sasaguri H, Nagata K, Sekiguchi M, Fujioka R, Matsuba Y, Hashimoto S, Sato K, Kurup D, Yokota T, Saido TC.
"Introduction of pathogenic mutations into the mouse Psen1 gene by Base Editor and Target-AID"
Nat. Commun., 2018 Jul 24;9(1):2892.
10.1038/s41467-018-05262-w - Nagata K, Takahashi M, Matsuba Y, Okuyama-Uchimura F, Sato K, Hashimoto S, Saito T, Saido TC.
"Generation of App knock-in mice reveals deletion mutations protective against Alzheimer's disease-like pathology"
Nat Commun., 2018 May 4;9(1):1800.
doi: 10.1038/s41467-018-04238-0 - Saito T, Matsuba Y, Mihira N, Takano J, Nilsson P, Itohara S, Iwata N, Saido TC.
"Single App knock-in mouse models of Alzheimer's disease"
Nat Neurosci., 2014 May;17(5):661-3.
10.1038/nn.3697 - Saito T, Suemoto T, Brouwers N, Sleegers K, Funamoto S, Mihira N, Matsuba Y, Yamada K, Nilsson P, Takano J, Nishimura M, Iwata N, Van Broeckhoven C, Ihara Y, Saido TC.
"Potent amyloidogenicity and pathogenicity of Aβ43"
Nat Neurosci., 2011 Jul 3;14(8):1023-32.
10.1038/nn.2858 - Iwata N, Tsubuki S, Takaki Y, Shirotani K, Lu B, Gerard NP, Gerard C, Hama E, Lee HJ, Saido TC.
"Metabolic regulation of brain Abeta by neprilysin"
Science, 2001 May 25;292(5521):1550-2.
10.1126/science.1059946
プレスリリース・メディア
-
-

-
次世代型「タウ病理」モデルマウスの開発
-
-
-

-
アミロイドベータの悪玉化機構を解明
-
-
-
-
ゲノム編集技術によるヘテロ接合型でのエクソン欠損霊長類の作製に成功
-
-
-
-
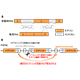
ドーパミンによるアミロイドβ分解機構の発見
-
-
-

-
西道 隆臣チームリーダーと齊藤 貴志客員研究員がHighly Cited Researchers 2022に選出
-
-
-
-
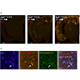
治療薬開発に適したアルツハイマー病モデルマウスの開発
-
-
-
-
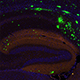
アルツハイマー病の新しい治療標的を発見
-
-
-
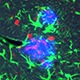
-
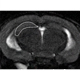
第三世代アルツハイマー病モデルマウスの作製
-
-
-
-
アルツハイマー病の悪性化に関わるタンパク質の発見
-
-
-
-
疾患モデルマウス作製の効率化に成功
-
-
-
-
ゲノム編集でアルツハイマー病を予防する
-
-
-

-
患者の症状に近いモデルマウスでアルツハイマー病の克服に挑む
-
-
-

-
次世代型アルツハイマー病モデルマウスの開発に成功
-アルツハイマー病研究に資する新規リソース基盤に-
-
-
-

-
副作用のないアルツハイマー病治療に向けての新技術
~アミロイドβたんぱく質産生の仕組みを利用~
-
-
-

-
アルツハイマー病の新しい遺伝子治療実験に成功
-
-
-

-
アルツハイマー病の血管からの投与による遺伝子治療実験に成功
-簡便な方法でアルツハイマー病予防となる潜在力をもつ-
-
-
-

-
アルツハイマー病の新たな発症メカニズムを解明
-治療薬開発とその評価法にも新手段を提唱-
-
-
-

-
アルツハイマー病の発症に関わるアミロイド前駆体タンパク質の新しい代謝経路を発見
-副作用の少ないアルツハイマー病治療薬の開発につながる可能性-
-
-
-

-
アルツハイマー病の重要な原因物質としてAβ43が浮上
-見過ごされていたアミロイドβ亜種が強力な病態促進因子-
-
-
-

-
脳血管内皮細胞特異的なアミロイドβ前駆体タンパク質を発見
-アルツハイマー病関連のアミロイドβ蓄積機構に新たな可能性-
-
-
-

-
アルツハイマー病の新たな治療標的を発見
- アミロイドβペプチドの分解を促進 -
-
-
-

-
アルツハイマー病の発症前診断へ大きく前進
- MRIでアミロイド斑の可視化に初めて成功 -
-
-
-

-
アルツハイマー病の根本的な治療薬を作る
-
-
-

-
アルツハイマー病の実験的遺伝子治療に成功
-
-
-

-
アルツハイマー病の原因となる酵素の働きを新たに発見
-
-
-

-
アルツハイマー病の原因となる酵素の働きを新たに発見
-原因酵素 βセクレターゼ は糖鎖の合成を調節していた -
-
-
-

-
孤発性アルツハイマー病の原因解明に大きく前進
-分解酵素の低下がアミロイド蓄積を促進することを実証-
-
-
-

-
脳内のβアミロイド分解系路を解明
-
-
-

-
脳内のβアミロイド分解系路を解明-アルツハイマー病の予防への道を開く―
-
メンバーリスト
主宰者
- 西道 隆臣
- チームリーダー
メンバー
- 齊藤 貴志
- 副チームリーダー
- 垣矢 直雅
- 研究員
- 永田 健一
- 研究員
- 笹栗 弘貴
- 研究員
- 橋本 翔子
- 基礎科学特別研究員
- 津吹 聡
- 専門職研究員
- 森島 真帆
- 研究嘱託
- 綿村 直人
- 大学院生リサーチ・アソシエイト
- 吉松 祥
- 大学院生リサーチ・アソシエイト
- 三平 尚美
- テクニカルスタッフⅠ
- 関元 みさき
- テクニカルスタッフⅠ
- 永井 由紀子
- テクニカルスタッフⅠ
- 松葉 由紀夫
- テクニカルスタッフⅠ
- 藤岡 亮
- テクニカルスタッフⅠ
- 釜野 直子
- テクニカルスタッフⅠ
- 髙橋 美華
- テクニカルスタッフⅠ