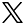脳内で起こる様々な生命現象の時空間パターンを可視化する技術を開発する。


宮脇 敦史, M.D., Ph.D.
細胞機能探索技術研究チーム チームディレクター
miyawaki-lab.ast@ml.riken.jp
研究内容
細胞の中を動き回る生体分子の挙動を追跡しながら、大洋を泳ぐクジラの群れをふと想うことがあります。クジラの回遊を人工衛星で追うアルゴスシステムのことです。背びれに電波発信器を装着したクジラを海に戻す時、なんとか自分の種の群に戻ってくれることをスタッフは願います。今でこそ小型化された発信器ですが昔はこれがかなり大きかった。やっかいなものをぶら下げた奴と、仲間から警戒され村八分にされてしまう危険がありました。クジラの回遊が潮の流れや餌となる小魚の群とどう関わっているのか、種の異なるクジラの群の間にどのような相互作用があるのか。捕鯨の時代を超えて、人間は海の同胞の真の姿を理解しようと試みてきました。バイオイメージング技術において、電波発信器の代わりに活躍するものとして蛍光プローブがあります。生体分子の特定部位に蛍光プローブをラベルし細胞内に帰してやれば、外界の刺激に伴って生体分子が踊ったり走ったりする様を実時間で観察することができます。蛍光は物理現象であり、その特性を活かせば様々な生命情報を抽出することができます。例えば、蛍光分子ドナー(エネルギー供与体)の励起エネルギーがアクセプター(エネルギー受容体)へ移動する現象(蛍光のエネルギー移動)は、ドナーとアクセプター間の距離および向きに依存するので、これを利用して生体分子間の相互作用や生体分子の構造変化を観ることができます。蛍光のエネルギー移動に限らず、蛍光の偏光、消光、退色、光異性化反応など、あらゆる特性が活用できます。細胞内のシグナル伝達系を記述するための同時観測可能なパラメータをどんどん増やす試みが重要でしょう。我々は、細胞の心をつかむためのスパイ分子を開発しています。材料となるのは主に蛍光タンパク質です。自ら発色団を形成して蛍光活性を獲得するタンパク質です。遺伝子導入技術の進歩のおかげで、蛍光タンパク質を利用したスパイ分子がますます活躍しています。我々はまた、新しい蛍光タンパク質を求めて、様々な生き物からの遺伝子クローニングを行っています。様々な物理特性を蛍光タンパク質から引き出して、新しいスタイルのイメージング技術を開発することを狙っています。超ミクロ決死隊を結成し、微小管の上をジェットコースターのように滑走したり、核移行シグナルの旗を掲げてクロマチンのジャングルに潜り込んだりして細胞の中をクルージングする、そんなadventurousな遊び心を保持したいと思います。大切なのは、科学の力を総動員すること、想像力をたくましくすること、そしてwhale watchingを楽しむような心のゆとりがserendipitousな発見を引き寄せるのだと信じています。
研究主分野
総合生物
研究関連分野
化学 / 生物物理学
キーワード
- バイオイメージング
- 蛍光タンパク質
- 発色団
主要論文
- Ando R., Shimozono S., Ago H., Takagi M., Sugiyama M., Kurokawa H., Hirano M., Niino Y., Ueno G., Ishidate F., Fujiwara T., Okada Y., Yamamoto M., Miyawaki A.:
“StayGold variants for molecular fusion and membrane-targeting applications.”
Nature Methods 21(4):648-656. (2024) - Hirano M., Ando R., Shimozono S., Sugiyama M., Takeda N., Kurokawa H., Deguchi R., Endo K., Haga K., Takai-Todaka R., Inaura S., Matsumura Y., Hama H., Okada Y., Fujiwara T., Morimoto T., Katayama K., Miyawaki A.:
“A highly photostable and bright green fluorescent protein.”
Nature Biotechnology 40:1132-1142. (2022) - Michikawa T., Yoshida T., Kuroki S., Ishikawa T., Kakei S., Kimizuka R., Saito A., Yokota H., Shimizu A., Itohara S., Miyawaki A.:
“Distributed sensory coding by cerebellar complex spikes in units of cortical segments.”
Cell Reports 37(6):109966. (2021) - Katayama H., Hama H., Nagasawa K., Kurokawa H., Sugiyama M., Ando R., Funata M., Yoshida N., Homma M., Nishimura T., Takahashi M., Ishida Y., Hioki H., Tsujihata Y., Miyawaki A.:
“Visualizing and modulating mitophagy for therapeutic studies of neurodegeneration.”
Cell 181: 1176-1187 (2020) - Iwano S., Sugiyama M., Hama H., Watakabe A., Hasegawa N., Kuchimaru T., Tanaka K. Z., Takahashi M., Ishida Y., Hata J., Shimozono S., Namiki K., Fukano T., Kiyama M., Okano, S., Kizaka-Kondoh H., McHugh, T.J., Yamamori T., Hioki H., Maki S., Miyawaki A.:
“Single-cell bioluminescence imaging of deep tissue in freely moving animals.”
Science 359: 935-939. (2018) - Sakaue-Sawano A., Yo M., Komatsu N., Hiratsuka T., Kogure T., Hoshida T., Goshima N., Matsuda M., Miyoshi H., Miyawaki A.:
“Genetically Encoded Tools for Optical Dissection of the Mammalian Cell Cycle.”
Molecular Cell 68: 626-640. (2017) - Miyawaki A.:
Roger Y. Tsien (1952-2016).”
Cell 167 (2): 298-300. (2016) - Miyawaki A.:
"Exploiting the cyanobacterial light-harvesting machinery for developing fluorescent probes."
Nature Methods, 13 (9): 729-730 (2016).
10.1038/nmeth.3983 - Hama H, Hioki H, Namiki K, Hoshida T, Kurokawa H, Ishidate F, Kaneko T, Akagi T, Saito T, Saido T, Miyawaki A.:
"ScaleS: an optical clearing palette for biological imaging."
Nature Neuroscience, 18 (10): 1518-1529 (2015).
10.1038/nn.4107 - Miyawaki A, Niino Y.:
"Molecular spies for bioimaging - Fluorescent protein-based probes."
Molecular Cell, 48 (4): 632–643 (2015).
10.1016/j.molcel.2015.03.002
プレスリリース・メディア
-
-

-
がん細胞を生体内の深部までリアルタイムに可視化
-
-
-
-
蛍光タンパク質StayGoldの性能アップ
-
-
-
-
血液の分解産物ビリルビンが植物で作られることを発見
-
-
-

-
StayGoldが放つあせない蛍光
-
-
-
-
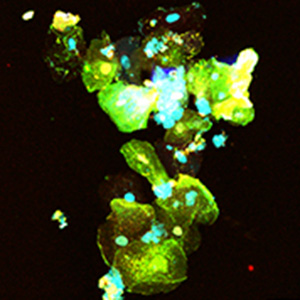
新型コロナウイルスを直接視る技術
-
-
-
-
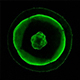
色褪せない蛍光タンパク質
-
-
-

-
小脳全体の可視化がもたらした新発見
-
-
-

-
宮脇 敦史チームリーダーがHighly Cited Researchers 2021に選出
-
-
-
-
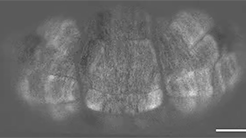
小脳の大規模可視化に成功
-
-
-
-
小脳の大規模可視化に成功
-
-
-

-
宮脇敦史チームリーダーが日本学士院賞を受賞
-
-
-
-
ミトコンドリアのマイトファジーを可視化する蛍光技術
-
-
-
-
肥満によるインスリン抵抗性の新しい分子機構を解明
-
-
-

-
脳の深部を非侵襲的に観察できる人工生物発光システムAkaBLI
―霊長類動物にも適用可能、高次脳機能のリアルタイム可視化への応用-
-
-
-

-
細胞周期の間期(G1・S・G2)を3色で識別する技術の開発
-細胞周期可視化技術Fucciの多様化で再生医療などに貢献-
-
-
-

-
アルツハイマー病の組織病変をズームイン
-老齢マウスやヒトの死後脳に適応可能な新しい透明化技術-
-
-
-

-
細胞内巨大プロテインクリスタルの運命
-
-
-

-
細胞内巨大プロテインクリスタルの運命
-自食機構によって隔離されるタンパク質結晶-
-
-
-

-
細胞の運命を決定するレチノイン酸の可視化に成功
-
-
-

-
ニホンウナギから人類初のビリルビンセンサー
―うなぎが光る仕組みを解明、その特性を利用して臨床検査蛍光試薬を開発―
-
-
-

-
ニホンウナギから人類初のビリルビンセンサー
-
-
-

-
動物の体つくりに重要なレチノイン酸の可視化に成功
-脊椎動物の胚でレチノイン酸が直線的な濃度勾配を形成-
-
-
-

-
“木も森も見る”生体の深部観察技術
-
-
-

-
生体を透明化する水溶性試薬「Scale」
-
-
-

-
生体をゼリーのように透明化する水溶性試薬「Scale」を開発
ー固定した生体組織を傷つけることなく、数ミリの深部を詳細に蛍光観察ー
-
-
-

-
細胞の自食現象(オートファジー)を高感度で定量的に検出するイメージング技術を開発
(科学技術振興機構(JST)プレスリリース)
-
-
-

-
蛍光イメージング技術によって抗がん剤の作用を再評価
-細胞周期をリアルタイムで解析する技術を創薬へ応用-
-
-
-

-
世界最高の検出感度をもつカルシウムイオンセンサー「カメレオン-Nano」の開発に成功!
-
-
-

-
魚の胚発生における増殖と分化、生きたまま観察に成功
-
-
-

-
魚の胚発生における増殖と分化のパターンが生きたまま丸見え
ーゼブラフィッシュで機能する蛍光性細胞周期の可視化プローブzFucciの開発ー
-
-
-

-
細胞周期のS/G2/M期特異的に細胞のシルエットを描出することに成功(科学技術振興機構(JST)プレスリリース)
-
-
-

-
蛍光タンパク質「ドロンパ」のフォトクロミズムの分子機構を解明へ
- X線結晶構造解析と核磁気共鳴(NMR)を駆使し、ドロンパの動的構造を決定 -
-
-
-

-
DNA複製や細胞分裂の様子をリアルタイムで観察する新技術
- 生物発生のメカニズム解明やがんの診療・治療薬開発に新たな道 -
-
-
-

-
新しい蛍光タンパク質 Keima(ケイマ)
- 生体の分子間相互作用を検出する優れた技術 -
-
-
-

-
フォトクロミック蛍光タンパク質、Dronpa(ドロンパ)
-
-
-

-
フォトクロミック蛍光タンパク質、Dronpa(ドロンパ)
- 新規蛍光タンパク質を使った書き換え可能な光メモリー技術の開発に成功 -
-
-
-

-
グリア細胞の接着によって完成する神経細胞の成熟
-
-
-

-
有機化学反応論を超えた、ペプチド鎖の新しい切断反応を蛋白質内で発見
- 蛍光蛋白質カエデの、紫(外)光で緑から赤に色が変換するメカニズム -
-
-
-

-
紫外光を受けて緑から赤に変化する新しい蛍光タンパク質
-
-
-

-
紫外光を受けて緑から赤に変化する新しい蛍光タンパク質ー光で細胞をマーキングできる強力な研究基盤ツールを開発ー
-
-
-

-
蛍光バイオイメージングで細胞内現象を可視化する
-
-
-

-
局所刺激による細胞内シグナルの伝播メカニズムを解明
-
-
-

-
生きた細胞を詳細に観察できる新しい蛍光タンパク質を開発
-
-
-

-
生きた細胞を詳細に観察できる新しい蛍光タンパク質を開発
―とらえられなかった細胞内現象を可視化―
-
メンバーリスト
主宰者
- 宮脇 敦史
- チームディレクター
メンバー
- GREIMEL Peter
- 専任研究員
- 安藤 亮子
- 研究員
- 阪上 朝子
- 研究員
- 深野 天
- 研究員
- 河野 弘幸
- 研究員
- 平野 雅彦
- 研究員
- 下薗 哲
- 研究員
- 片山 博幸
- 研究員
- 道川 貴章
- 研究員
- 杉山 真由
- 研究員
- 黒川 裕
- 研究員
- 新野 祐介
- 研究員
- 並木 香奈
- 研究員
- 小松 直貴
- 研究員
- 岩野 智
- 基礎科学特別研究員
- 濱 裕
- 専門職研究員
- 庄田 恵子
- テクニカルスタッフⅠ
- 小暮 貴子
- テクニカルスタッフⅠ
- 伊藤 梨絵
- テクニカルスタッフⅠ
- 星田 哲志
- テクニカルスタッフⅠ
- 戸崎 麻子
- テクニカルスタッフⅡ
- 久保田 美咲
- テクニカルスタッフⅡ